Actualmente una parte de la población mundial se puede permitir el lujo de elegir su dieta: omnívora, vegetariana, vegana, crudívora, carnívora, paleodieta… pero ¿qué comían nuestros antepasados? ¿Qué dieta se ajusta más a la de nuestros ancestros? Sin querer entrar en polémica, hablaremos sobre uno de los hechos cruciales del paso de Australopitechus a Homo: la ingesta de carne.
¿QUÉ COMEN NUESTROS PARIENTES?
Una de las razones que se esgrimen para seguir una dieta vegana o vegetariana estricta es que como somos monos, éstos se alimentan de frutas y plantas, y además, así se consigue una dieta más natural. Actualmente y tradicionalmente la base de la alimentación mundial son las semillas de cereales (arroz, trigo, maíz, etc.) y legumbres (judías, lentejas…), que muchas veces precisan elaboración (la harina, por ejemplo) y no tienen nada que ver con sus antepasados silvestres. Desde que se inventó la agricultura y ganadería y se han seleccionado las mejores variedades para consumo humano, la etiqueta de “natural” pierde todo su sentido. Aunque ahora los transgénicos están en boca de todos, en realidad la modificación genética la venimos haciendo desde hace miles de años.

Que seamos monos y por ello lo natural es comer vegetales, tampoco es del todo cierto. Como los primates hemos evolucionado en los árboles, los homínidos tienen una dieta estricta o principalmente folívora -hojas- y frugívora -fruta- (gorilas, orangutanes), mientras que los gibones, además, completan la dieta con invertebrados. Nuestros parientes más cercanos sin embargo (bonobos, chimpancés), son omnívoros, ya que se alimentan de vegetales, fruta, invertebrados y hasta pequeños mamíferos y otros primates, aunque eso sí, en menor cantidad que de vegetales.

No es de extrañar pues, que nuestros ancestros directos lejanos, australopitecos como Lucy, tuvieran las hojas, frutas, raíces y tubérculos como base de su dieta. Algunas especies, además de vegetales, también se alimentaban de invertebrados y pequeños vertebrados, de manera similar a los actuales chimpancés.
HERBÍVOROS Y CARNÍVOROS
Los frutos tienen más azúcares, aunque no son muy abundantes en comparación con las hojas y tallos. Por contra, las hojas tienen menor valor nutritivo, ya que contienen muchas fibras que no podemos asimilar, como la celulosa. Las legumbres contienen más proteínas que los cereales, pero algunos aminoácidos esenciales y vitaminas (como la B12) son inexistentes en algunos vegetales o se encuentran en muy baja proporción, u otros como el hierro de fácil asimilación (hierro hemo) sólo se encuentran en alimentos de origen animal.
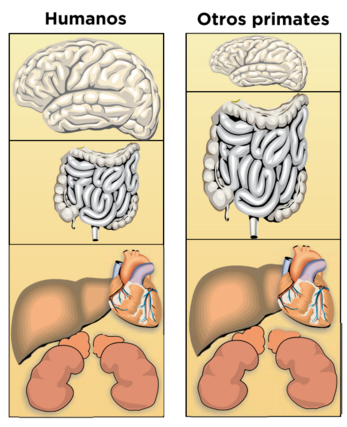
En resumen, los vegetales son más difíciles de asimilar comparado con los animales, por lo que mamíferos herbívoros presentan sistemas digestivos más largos, o con estómagos compartimentados, mastican durante largos periodos de tiempo y algunos son rumiantes, mientras que los carnívoros tienen sistemas digestivos con menor superficie de absorción y precisan poca masticación del alimento.

¿POR QUÉ NUESTROS ANCESTROS EMPEZARON A COMER MÁS CARNE?
Hace 2,6 millones de años, un cambio climático hizo nuestro planeta más frío y seco. En África la sabana dominaba gran parte del territorio, por lo que los homínidos tenían que contentarse con hojas duras, recubiertas de ceras, tallos duros o con espinas, raíces… estos recursos difíciles de digerir fueron explotados por los parántropos (Paranthropus), con grandes dientes y potentes musculaturas en la mandíbula para poder triturarlos, aunque con un cerebro similar al de los australopitecus. Se extinguieron hace un millón de años.

Pero otro grupo de homininos encontró un tipo de recursos que les ofrecían más energía en menor cantidad, y eran más fáciles de masticar: la carne. Homo habilis fue el primero en comer carne en mayor proporción que el resto de parientes y además, carnes con más cantidad de grasa. Se trataba de un oportunista: casi cualquier cosa comestible la aprovechaba, por contra los Paranthropus eran especialistas, por lo que si escaseaba su alimento, lo más probable era que murieran.
CEREBROS GRANDES…
Mientras que Australophitecus y Paranthropus tenían una capacidad craneana de 400-500 cm3, Homo habilis llegó a tener hasta 700 cm3. Este mayor tamaño cerebral le permitía una mayor capacidad de improvisación y versatilidad para encontrar alimento.
Una de las cosas que nos diferencia claramente del resto de primates y animales es el gran tamaño de nuestro cerebro. Como habréis observado, H. habilis ya se clasifica dentro del género Homo, el nuestro, por ese gran salto de tamaño cerebral, entre otras cosas.

Pero un cerebro grande también tiene inconvenientes: en Homo sapiens el 25% de energía de nuestro cuerpo lo consume el cerebro en reposo, H. habilis consumía el 15% y Australopithecus solamente el 10%. Además de cantidad, esta energía también tiene que sera de calidad: algunos ácidos grasos para un correcto funcionamiento del cerebro sólo se encuentran en algunos frutos secos, pero sobretodo, en grasa de origen animal, más fácil de conseguir si escaseaban los vegetales.

…INTESTINOS PEQUEÑOS…
La única manera de poder dedicar más energía al funcionamiento del cerebro es reducir el tamaño de otros órganos que consuman mucha energía (Aiello, L. y Wheeler, P, 1995). Corazón, riñones, hígado, son grandes consumidores de energía pero vitales, por lo que la solución es reducir el tubo digestivo y eso sólo fue posible con el paso de una dieta casi exclusivamente vegetariana de los Australophitecus a otra de más fácil asimilación con más contenido de proteínas y grasa animal de H. habilis.
… Y HERRAMIENTAS
Un cerebro grande dio además otra ventaja a H. habilis. A pesar de su físico (pequeño tamaño, sin garras ni grandes colmillos) pudo explotar gran variedad de carne (primero como carroñeros y luego cada vez más como cazadores) debido al uso de herramientas. Probablemente los australopitecos usaran algún tipo de herramienta sencilla, mayoritariamente de madera, pero las primeras pruebas seguras que disponemos de fabricación de herramientas de piedra (líticas) pertenecen a H. habilis. Esto hasta les permitió aprovechar el tuétano interior del hueso de grandes presas abatidas por carnívoros cuando toda la carne ya había sido consumida por otros animales. Actualmente sólo las hienas y quebrantahuesos pueden acceder sin herramientas a este recurso. Al no necesitar unos dientes y mandíbulas tan grandes, el cráneo puede alojar un cerebro más grande.

CONCLUSIÓN
En resumen, el aumento del cerebro de Homo fue posible gracias al cambio de dieta, que permitió un tubo digestivo más corto y un aparato masticador más pequeño. A su vez, para obtener estos alimentos más energéticos se precisa más inteligencia, que dio como resultado comportamientos más complejos como el uso de herramientas trabajadas (tecnología lítica Olduvayense, Modo 1).
Nuestro aparato digestivo es el resultado de millones de años de evolución como omnívoros oportunistas. Algunas dietas actuales estrictas (ya sean vegetarianas o casi carnívoras) entran en contradicción con esta herencia biológica y el abuso y acceso a todo tipo de alimentos nos acarrean todo tipo de alergias y problemas alimentarios. El secreto sigue siendo una dieta equilibrada y variada.
REFERENCIAS
- Roberts A (2002). Evolución: historia de la humanidad. Akal, UK.
- Mateos A, Rodríguez J (2010). La dieta que nos hizo humanos. CENIEH, Burgos.
- Arsuaga J L, Martínez I (2006). La especie elegida. La larga marcha de la evolución humana. Booket divulgación.
- Potts, Richard. Sloan, Christopher (2010). What does it mean to be Human? Ed. National Geographic Society.
- Vegetarianismo – Aspectos nutricionales a tener en cuenta cuando te planteas ser vegetariano
- Paleodieta: hábitos prehistóricos para otra dieta milagro (OCU)